- Ley de Boyle
A temperatura constante, el volumen es inversamente proporcional a la presion. Es decir si el volumen aumenta la presion disminuye y viceversa.
P1xV1=P2xV2
VER VIDEO: En este video vemos la definicion mediante imagenes sobre la ley de boyle.
http://www.youtube.com/watch?v=Z7wMLafju3g&feature=quicklist
- Ley de Charles
A presion constante, el volumen de la masa fija de una gas es directamente proporcional a la temperatura en Kelvin. Es decir si el volumen aumenta, la temperatura aumenta.
V1xT1=V2xT2
VER VIDEO: En este video vemos la ley de charles y un experimento.
http://www.youtube.com/watch?v=EVhhrbjTCMY&feature=quicklist
- Ley de Gay-Lussac
A volumen constante, la presion de un gas es directamente proporcional a la temperatura. Es decir que si la presion aumenta, la temperatura tambien aumenta.
P1xT1=P2xT2 - Ley Combinada de los Gases
Para una masa determinada de cualquier gas, se cumple que el producto de la presion por el volumen dividido entre el valor de la temperatura es una constante
P1xV1/T1=P2xV2/T2 - Ley de Dalton
La presion ejercida por la mezcla de los gases es igual a la suma de las presiones parciales de todos ellos
P total = P1 + P2 + P3...
VER VIDEO
http://www.youtube.com/watch?v=xwKpXEUds0c&NR=1
Este video explica las teorias de los gases y tiene experimentos
- Principio de Avogadro
establece la relación entre la cantidad de gas (n) y su volumen cuando se mantienen constantes la temperatura y la presión.
el volumen (v) es directamente proporcional a la cantidad de gas (n)


el volumen (v) es directamente proporcional a la cantidad de gas (n)


http://www.youtube.com/watch?v=nzpMgNcDljM
este video explica claramente la relacion entre volumen y cantidad de gas explicada en el principio de Avogadro.
- Ley Gases Ideales.


. El valor de R (constante de los gases ideales) puede determinarse experimentalmente y tiene un valor de 0,082 (atm.L/K.mol ).
- Ley De Graham:
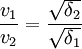
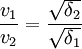
Siendo v las velocidades y δ las densidades.
ejemplo:
¿Cuál es la velocidad de efusión del oxígeno con respecto al hidrógeno?
Si la masa molar del oxígeno es 32 y la del hidrógeno es 2 (gases diatómicos):
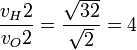
La velocidad de efusión del hidrógeno es 4 veces mayor que la del oxígeno.
No hay comentarios:
Publicar un comentario